最近,澳门太阳娱乐网站官网生物医学工程系陈匡时">陈匡时(Antony K. Chen)与美国国家科学院、医学院双院院士Jennifer Lippincott-Schwartz 以及HIV 病毒学家Eric O. Freed 合作, 发现了宿主细胞抵御HIV 病毒感染的新机制。该研究成果已发表于《美国科学院院报》(PNAS,链接:http://www.pnas.org/content/early/2014/06/16/1408037111.full.pdf+html)
先前的研究显示,RNA-蛋白交互作用在HIV病毒颗粒形成过程中扮演着重要的角色。HIV-1 Gag是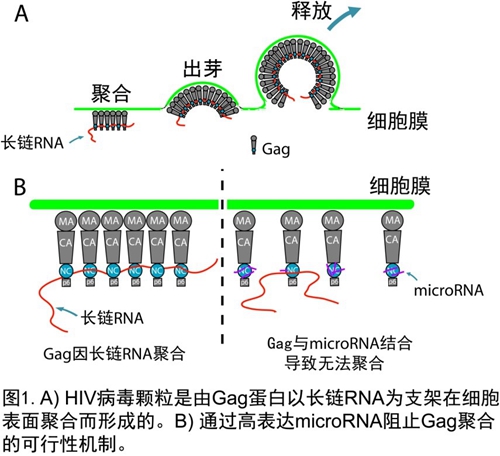 HIV的主要结构蛋白,具备RNA 结合位点 (nucleocapsid domain, NC). 通过与HIV RNA结合, Gag蛋白能以RNA 为支架, 在宿主细胞膜上大量聚合, 最终形成含有数千个Gag的 病毒颗粒 (图1A)。进一步的研究表明,Gag也能与其它RNA如细胞内源长链RNA非特异性结合,并且支持Gag 聚合的RNA链越长,所形成的病毒颗粒越大。陈匡时">陈匡时等人据此提出假设:高表达细胞自身的microRNA(一种仅长约22个核苷酸的非编码小RNA), 能迫使microRNA与HIV-1 Gag蛋白非特异性地结合,从而干扰Gag 与长链RNA 的结合,抑制HIV病毒颗粒的形成和传播(图1B)。
HIV的主要结构蛋白,具备RNA 结合位点 (nucleocapsid domain, NC). 通过与HIV RNA结合, Gag蛋白能以RNA 为支架, 在宿主细胞膜上大量聚合, 最终形成含有数千个Gag的 病毒颗粒 (图1A)。进一步的研究表明,Gag也能与其它RNA如细胞内源长链RNA非特异性结合,并且支持Gag 聚合的RNA链越长,所形成的病毒颗粒越大。陈匡时">陈匡时等人据此提出假设:高表达细胞自身的microRNA(一种仅长约22个核苷酸的非编码小RNA), 能迫使microRNA与HIV-1 Gag蛋白非特异性地结合,从而干扰Gag 与长链RNA 的结合,抑制HIV病毒颗粒的形成和传播(图1B)。
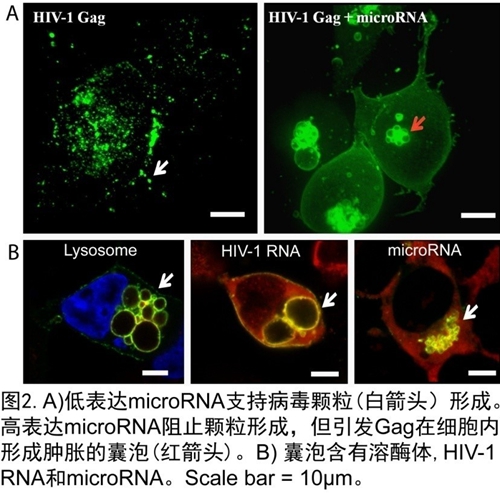
结合高分辨率荧光显微镜技术、细胞生物学以及生化等手段,陈匡时">陈匡时与合作者证实,microRNA能与Gag结合形成microRNA-Gag复合体, 且该复合体能破坏Gag组装平台, 使病毒颗粒无法有效释放。 而组装失败的Gag平台将无法抵抗细胞的内吞机制(endocytosis),从而聚集在溶酶体(lysosomes),最终被降解(图2)。
与之前研究对microRNA功能的普遍认识(靶向特异mRNA 并导致基因沉默)不同,陈匡时">陈匡时等人发现microRNA能“非特异性“地断阻HIV 病毒颗粒形成。这一新机制有望为治疗艾滋病或其它逆转录病毒引起的疾病提供新的思路。该工作的一部分在北大完成,并得到了国家自然科学基金的资助。
陈匡时">陈匡时2013年4月入职澳门太阳娱乐网站官网,为生物医学工程系特聘研究员,是该论文的第一作者。他的研究方向为细胞与分子影像相关的科学问题,目前主要研究内容为RNA 分子探针技术研发,探索 RNA-蛋白交互作用对细胞生理以及疾病发生的影响,病毒与宿主细胞交互作用,分子医学等。陈匡时">陈匡时实验室欢迎本科生、研究生以及博士后的加入。









